新藥開發研究人員(使用者)對於粗萃取物藥庫篩選後的開發風險依然會有較高的疑慮。認為由萃取物開始到找到活性成分的時間過久、重新製備的萃取物無法重現生物活性、或者因為活性在純化、分離的過程中失去,而無法確認有效成分。
為了解決這個問題,我們將利用活性導引分離純化−質譜/分子網絡分析−靶向式分離純化的策略提供使用者快速鑑定、並分離出活性成分的服務。
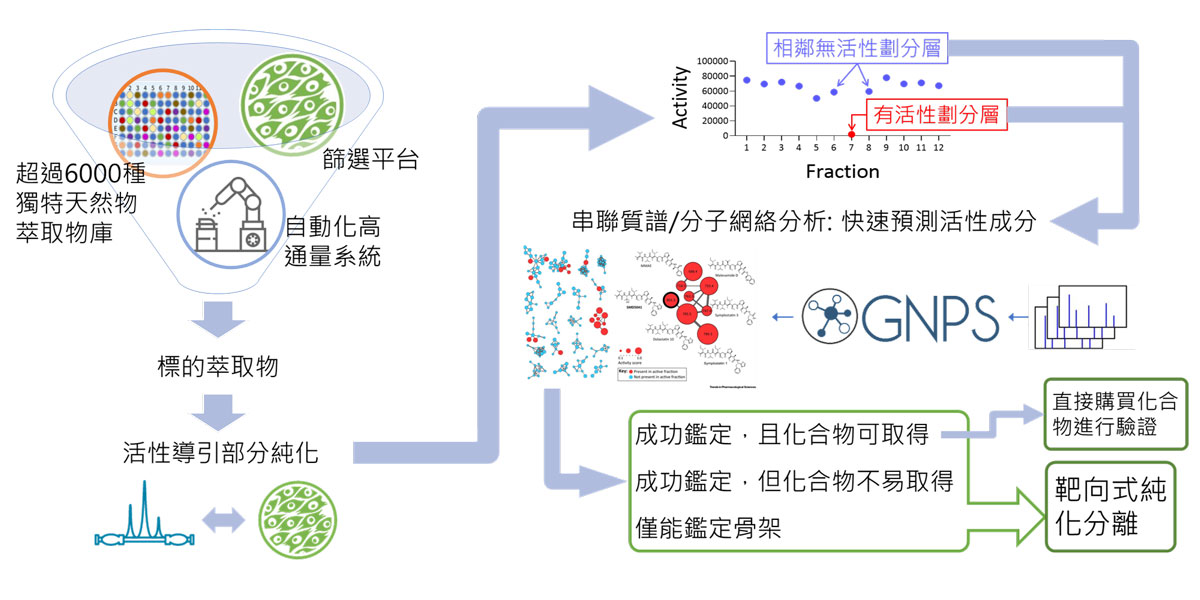
說明如下: 活性導引分離純化是傳統上天然物開發所使用的策略,需要天然物化學團隊與基礎醫學研究團隊緊密的配合,在每次的分離後,進行活性測試找出有效的劃分層,再將此劃分層再次進行分離、活性測試。重複這個過程,直到找出具有活性的純化合物。但由於上述的問題,讓這個策略的成效相當有限,因此需要更好的天然物開發策略。
自1960年代晚期,質譜便被廣泛地運用於檢測生物檢體內的代謝產物。非標的式的串聯質譜分析更是目前代謝組學研究中用來發現與註解新代謝物的主要策略之一。非標的式的串聯質譜可以偵測一個混合樣品中,所有被離子化的化合物的化學特徵。所謂的「化學特徵」指的是每個化合物被撞擊後產生的所有碎片的分子離子峰圖譜。一般來說具有相似結構的化合物,在撞擊後會產生相同碎片,而在質譜分析上出現相同分子離子峰圖譜。因此根據這些質譜結果的「化學特徵」,進行相似性比對,便可將混和樣品中的化合物依照結構歸類,並分析每個化合物之間的關聯性,再以網路連結式的視覺化呈現,產生「分子網絡」。再將這個網絡配合上樣品活性分析的結果,將可以進一步找出活性來源的化合物群;同時也可以與現有公開的質譜資料庫進行比對,將已知的化合物鑑定出來,從而辨識出全新的活性化合物。這也是過去幾年新興的天然物開發的策略。
目前主要都是利用GNPS的資料庫進行分子網絡分析(Global Natural Product Social Molecular Networking, GNPS-MN)。舉例來說,如下圖所示,先利用高通量篩選找出候選萃取物,進行活性導引分離純化(不超過2個循環),並將有活性以及前後相鄰無活性的劃分層同時進行質譜/分子網絡分析,並利用化合物在有活性層與無活性層內含量相關性來進行註解,就能找出具有活性的化合物群,同時由於在註解的過程中會與現有公開的質譜資料庫進行比對,來標記出已知的化合物,也就是說,無法被標註的活性化合物可能就是新穎的活性化合物。
而針對潛在的新穎活性化合物,我們將進行靶向式純化分離:在每次分離後,利用串聯質譜分析,追蹤含有該新穎目標化合物之分子離子峰圖譜的劃分層,直到分離出純化合物。也就是說,這個策略不但可以快速找出活性成分,同時也能發現新穎的活性成分。
此外相較於傳統上利用活性導引分離純化的方式嘗試找出活性成分,這個新的策略省去了過程中需要進行活性驗證所需耗費的時間與成本,更能加速天然物新藥的開發與應用。
參考文獻:
○ Watrous, J., Roach, P., Alexandrov, T., Heath, B.S., Yang, J.Y., Kersten, R.D., van der Voort, M., Pogliano, K., Gross, H., Raaijmakers, J.M., et al. (2012). Mass spectral molecular networking of living microbial colonies. Proc Natl Acad Sci U S A 109, E1743-1752.
○ Quinn, R.A., Nothias, L.F., Vining, O., Meehan, M., Esquenazi, E., and Dorrestein, P.C. (2017). Molecular Networking As a Drug Discovery, Drug Metabolism, and Precision Medicine Strategy. Trends Pharmacol Sci 38, 143-154.
○ https://gnps.ucsd.edu/ProteoSAFe/static/gnps-splash.jsp